Zkoumat proteiny, nukleové kyseliny, ale také další biomolekuly není jednoduché. Vědci proto často používají k jejich značení fotochemicky kontrolované bioorthogonální reakce. Právě jejich studiu zasvětil svou stáž na německé Goetheho univerzitě stipendista Nadace Experientia Tomáš Slanina. V současné době se intenzivně zkoumají možnosti využití nekódující RNA jako farmaceutika. Jedná se o velmi významnou oblast výzkumu, nekódující RNA by se dala totiž aplikovat při léčbě široké škály nemocí. „Jsou známy studie o významu mikroRNA při angiogenezi i při proliferaci buněk, čili v rámci výzkumu rakoviny. My využíváme biologický model myší s infarktem, u nichž se snažíme za pomoci mikroRNA-34a zvýšit regeneraci tkáně po infarktu,“ říká Tomáš Slanina.
Ve svém výzkumu se věnujete fotochemicky kontrolovaným bioorthogonálním reakcím. Můžete vysvětlit, o jaké reakce se jedná?
Bioorthogonální reakce neprobíhají ve zkumavce, ale za biologických podmínek – ve vodě, v živých buňkách, v přítomnosti jiných biomolekul a jiných funkčních skupin. Také naše tělo je složeno z biomolekul, které jsou více či méně reaktivní. Bioorthogonální reakce byly vyvinuty proto, abychom mohli biomolekuly kontrolovat v jejich přirozeném prostředí. Většina reakcí, které známe, jsou reakce termické. My ovšem zkoumáme reakce, které fungují na fotochemickém principu. Na takové reakční směsi je potřeba svítit. Energie fotonů absorbovaného záření umožní provést reakci. Ve chvíli, kdy ozařování přerušíme, fotochemický proces skončí. To znamená, že dokážeme přesně kontrolovat čas, kdy reakce začne, ale také místo, kde začne. Dokážeme zaměřit laser na určitou oblast v organismu, abychom tam vyvolali požadovanou změnu.
Jak jste zmínil, pracujete na látkách, které mohou být aktivovány viditelným světlem. Na jakém principu váš projekt funguje?
Látky, se kterými pracujeme, jsou barevné, což je nutný předpoklad k tomu, aby se daly aktivovat viditelným světlem. Používáme známá barviva, která absorbují světlo velmi účinně a která jsou modifikována tak, že se následně definovaným způsobem rozpadají. Fotoaktivovatelnou látku (tzv. linker, obr. 1) navrhujeme tak, aby měla na obou koncích funkční skupiny, které dokážou bioorthogonálně reagovat s modifikovanou biomolekulou, konkrétně s oligonukleotidem (či modifikovanou RNA), jehož sekvence bází je komplementární k sekvenci určité mikroRNA. Modifikovanou RNA připravujeme ze základních stavebních kamenů pomocí syntézy na pevné fázi. Na obou koncích je substituována alkynem (nebo jeho prekurzorem) a může tak reagovat s fotoaktivovatelným linkerem, který jej při vhodném nastavení reakčních podmínek cyklizuje (obr. 1). Cyklická RNA je biologicky neaktivní a může být aplikována do organismu, aniž by vyvolala změny v biochemických procesech. Nekomplexuje se totiž s ostatními nukleovými kyselinami pomocí Watson-Crickových interakcí.

Obrázek 1: Modifikovaná RNA je připravena pomocí syntézy na pevné fázi ze stavebních kamenů (vlevo). Takto upravená biomakromolekula dále reaguje pomocí bioorthogonální reakce s fotoaktivovatelným linkerem, který ji cyklizuje. Tato cyklická RNA neinteraguje s komplementární mikroRNA v organismu (vpravo).
MikroRNA mají v organismu velice důležitou regulatorní funkci. Když k cílové mikroRNA přidáme komplementární řetězec, dokážeme její aktivitu vypnout. RNA je totiž ve své podstatě jednořetězcová. Když k ní přidáme dvojče, které je k ní komplementární, hybridizuje se s ní za vzniku dimeru. Takto vytvořený duplex je již neaktivní, a tím pádem se neúčastní biochemických procesů (obr. 2). Abychom tuto regulaci mohli kontrolovat pomocí světla, používáme fotoaktivovatelné cyklické RNA, které aplikujeme přímo do buněk a tkání. Ve chvíli, kdy na část tkáně zasvítíme červeným laserem, dochází v tomto místě k rozpadu linkeru (obr. 2) a tvorbě lineární RNA. Fotoprodukt po rozpadu linkeru je fluorescentní, což je vhodné pro sledování uvolněné lineární RNA pomocí fluorescenčních zobrazovacích technik. Tato metoda tedy umožňuje nejen místně a časově kontrolovat vypnutí funkce mikroRNA, ale také sledovat tento proces v přímém přenosu.
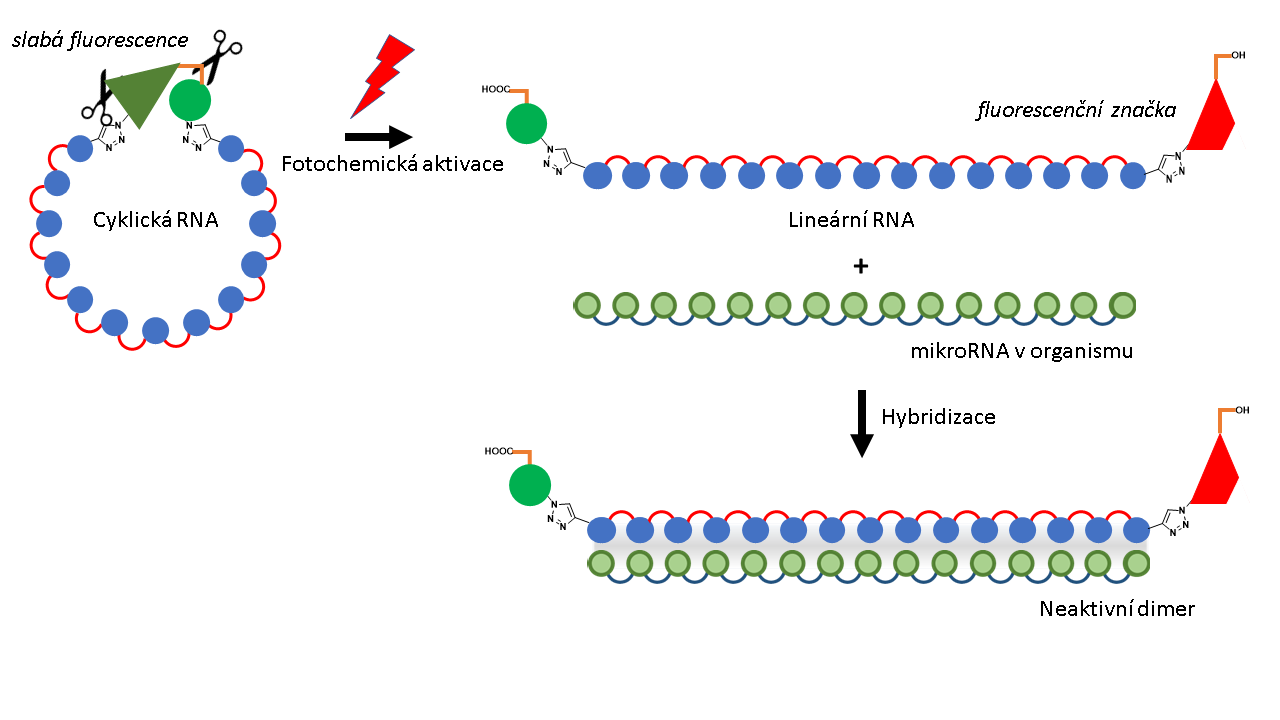
Obrázek 2: Viditelné světlo (symbol červeného blesku) rozštěpí slabě fluorescenční linker na dvou místech (symbol nůžek). Vzniká tak lineární RNA opatřená fluorescenční značkou (červený lichoběžník). Lineární RNA je konformačně flexibilní a může hybridizovat s mikroRNA v organismu a zablokovat její funkci tvorbou neaktivního dimeru (vpravo dole).
Velmi zajímavé jsou jak biologické, tak chemické aplikace bioorthogonálních reakcí. Kde všude se dají využít?
Používají se převážně v základním výzkumu. Biomolekuly jako takové se zkoumají velmi komplikovaně, je potřeba je nějak označit, abychom například dokázali pozorovat, jak se v buňce nebo v organismu distribuují, jak rychle probíhají jejich různé přeměny apod. Značení se často provádí pomocí značek, které je třeba do těchto molekul nějakým způsobem zabudovat. Jedním z nejvhodnějších postupů se ukázaly právě bioorthogonální reakce. Postupuje se tak, že se připraví molekula, která má bioorthogonálně aktivní funkční skupinu a potom se na toto místo selektivně naváže značka, například fluorescenční barvička. Takto označený protein nebo nukleovou kyselinu můžeme pozorovat například pomocí fluorescenční mikroskopie.
Co může váš objev znamenat pro farmaceutický průmysl?
Využití nekódující RNA jako farmaceutika je momentálně předmětem velmi intenzivního zkoumání. Jedna z možných aplikací je prostá administrace RNA. Tím, že buď zvýšíme hladinu mikroRNA, nebo ji naopak zablokujeme pomocí komplementárního řetězce anti-miRNA, můžeme regulovat řadu signálních cest a funkcí v organismu. Jedná se o biogenní způsob, jak organismus donutit udělat něco, pro co v danou chvíli nemá dispozice. Tím, že zasahujeme přímo do regulačních mechanismů, vytváříme terapeutikum, které má úplně jiný mechanismus účinku než velká část dosud používaných léčiv. Dokáže totiž jemně vyladit koncentraci určitých proteinů a dostat je přímo na místo určení.
Pro které nemoci by se toto terapeutikum dalo využívat?
Náš přístup je velmi obecný, takže může cílit na širokou škálu nemocí. Existují například studie o významu mikroRNA při angiogenezi, při proliferaci buněk, čili v rámci výzkumu rakoviny, ale je tu také možnost využití v případě zánětlivých reakcí. My využíváme biologický model myší s infarktem, u nichž se snažíme za pomoci regulace mikroRNA-34a zvýšit regeneraci tkáně po infarktu. MikroRNA-34a je poměrně nebezpečný řetězec, proto je třeba jeho koncentraci správně kontrolovat. Snažíme se regulovat jeho koncentraci ve tkáni tak, aby vyvolal kýžený efekt bez vedlejších účinků.
Váš výzkum je tedy ve své podstatě multidisciplinární?
Určitě. Začínáme teoretickou chemií – návrh molekul je racionálním designem na základě fotofyzikálních vlastností, které by cílová molekula měla splňovat. Následuje syntetická organická chemie, potom fyzikálně-chemické měření parametrů molekul (jaké světlo absorbují, jak efektivně vzniká jejich fluorescence, jakým způsobem, jak účinně a na jaké produkty se fotochemicky rozpadají apod.). Pak je na řadě chemicko-biologická část, při níž společně s kolegyní syntetizujeme biomakromolekuly, konkrétně oligonukleotidy, které následně funkcionalizujeme a cyklizujeme. A nakonec spolupracujeme s fakultní nemocnicí ve Frankfurtu, kde nám dělají testy na biologických modelech na aktivaci v krvi, metabolismus látek, biostabilitu, toxicitu apod.
Proč jste se specializoval právě na tuto oblast chemie?
Už od prvního ročníku bakalářského studia Masarykovy univerzity v Brně jsem tíhnul k organické chemii, přišlo mi to jako nejzajímavější odvětví vědy. V organické chemii nepotřebujete obrovské množství encyklopedických znalostí, abyste pochopila základní principy. Dalo by se to přirovnat k matematice. Když si k tomu ještě osvojíte určité laboratorní dovednosti, dokážete si molekuly syntetizovat, vyčistit, či analyzovat. Vždy se mi líbilo, že kontakt s chemií není jen přes monitor počítače, ale je přímý. Posléze jsem se specializoval na fotochemii, tedy na aktivaci molekul pomocí světla. Začínal jsem ve výzkumné skupině prof. Klána, který je fotochemik, oblast mi přirostla k srdci a zůstal jsem jí věrný dodnes. Na svých stážích jsem se pak vydal do oblasti chemické biologie, kde se fotochemie používá jinak, ale i zde je velmi důležitá. V biovědách obecně vidím velkou budoucnost, a proto si myslím, že je důležité být interdisciplinární.
Díky grantu Nadace Experientia jste vycestoval na roční pobyt ve skupině skupina prof. Heckela na německé Goetheho univerzitě. Čím vás prof. Heckel oslovil?
Oslovil mě tím, že kombinuje fotochemii s pro mne úplně novým odvětvím chemické biologie. Práce s biomolekulami pro mě byla hodně exotická a říkal jsem si, že bych se hrozně rád něco takového naučil. Nechtěl jsem vycestovat do laboratoře, kde se specializují pouze na chemickou biologii, protože jsem chtěl také já přispět skupině svými znalostmi. U profesora Heckela se to povedlo. Mohli jsme oboustranně profitovat z toho, co umíme, a vznikl z toho velmi pěkný projekt. Díky tomu jsem mohl na stáži zůstat o půl roku déle.
Na čem pracuje výzkumný tým prof. Heckela a jakou část výzkumu jste u něj měl na starosti vy?
Tým pracuje na několika výzkumných tématech, která spojuje využití světla pro regulaci funkce biomolekul. Regulace může být různá – jednak je to cyklizace RNA, na které pracujeme my, ale máme tady i doktorandy, kteří se zabývají regulováním iontových kanálů v membránách pomocí světla, nebo DNA nanoarchitekturou, syntetizují různé ligandy pro regulaci exprese RNA na bázi riboswitchů, či vyvíjejí nové fotoaktivovatelné molekuly.
Jak vypadala spolupráce s prof. Heckelem? Jakým systémem pracuje a co jste se od něj zásadního přiučil?
Profesor Heckel je mladý, dynamický profesor, který kolem sebe šíří nadšení pro vědu. Dal mi absolutní volnost v tom, co jsem chtěl dělat, ale na druhou stranu kdykoliv jsem potřeboval poradit, vždy byl po ruce. Zprostředkoval mi spoustu kontaktů s lidmi, kteří jsou experty v oboru a se kterými jsem se mohl poradit. Motivoval mě v tom, že jsem vážně začal uvažovat o akademické kariéře.
A jaké byly vaše dojmy z německé Goetheho univerzity? Měl jste už zkušenosti z joint Ph.D. z univerzity v Řezně. V čem se tamní vědecké prostředí liší od českého?
Liší se poměrně výrazně. V Německu 95 % lidí, kteří vystudují chemii, pokračuje v Ph.D. studiu, doktorát je zde masovou záležitostí. Zároveň ale 95 % Němců, kteří ukončí doktorát, chce do průmyslu. Očekávají, že jakmile skončí doktorát, už v životě nevejdou do laboratoře. Většina z nich chce dělat manažera v chemickém průmyslu. Jejich motivace je úplně jiná než u nás. My jsme byli srdcaři a měli jsme nadšení pro vědu, tady je to spíše fajfka, kterou si člověk musí v životě odškrtnout.
Jaký cíl stáže jste si vytkl, když jste na ni jel?
Jel jsem na stáž přemluvit vědu, aby fungovala. Měli jsme velké štěstí, že se tak nakonec stalo, takže jsem spokojený.
V rámci stáže jste vydali publikaci v Journal of the American Chemical Society. O čem pojednává?
Publikace s názvem „In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups“ se zabývá se vývojem nových fotoodstupitelných chránicích skupin na bázi BODIPY (fluorescentní barvivo, pozn. red.) a myslím si, že bude mít velký dopad. Podařilo se nám totiž optimalizovat skupinu látek tak, aby chemická reakce probíhající po absorpci viditelného světla měla takřka stoprocentní účinnost. To je absolutně výjimečné, jiná taková látka, alespoň pokud víme, neexistuje.
Mnoho stipendistů si svůj zahraniční pobyt prodloužilo, vy jste byl jedním z nich. Jaké jsou vaše plány do budoucna?
Mířím na další postdoktorandskou stáž k profesoru Ottossonovi do švédské Uppsaly. I on se zabývá fotochemií, ale zase z jiné perspektivy. Studuje aromaticitu molekul v excitovaném stavu.
Můžete na závěr říci, co pro vás osobně znamenal grant od Nadace Experientia a jak vás stáž, na kterou jste mohl díky nadaci vycestovat, kariérně, ale třeba i lidsky posunula?
Pro mě to byla příležitost pracovat 12 měsíců na výzkumu, který jsem si navrhl, sám jsem ho vedl a nebyl jsem omezen ničím a nikým. Ta absolutní volnost mi přišla vůči Nadaci Experientia velmi zavazující. Chtěl jsem ukázat, že vědu beru vážně a že bych rád měl co nejlepší výsledky. Určitě se jedná o důležitý katalyzátor v kariéře. Změnilo to ovšem i způsob, jakým přemýšlím o vědeckém světě a o své budoucnosti.
Co byste vzkázal potenciálním žadatelům o grant Nadace Experientia?
Fandím jim a doporučil bych to všem. Musím říci, že jak samotná žádost, tak i řízení administrativy je úplná brnkačka. Také bych poradil všem budoucím stipendistům, pokud vyjednávají o své pozici, aby se už od začátku ptali na to, jestli je možnost nějakého interního financování, protože ten rok, pokud to člověk bere vážně, je velmi krátký.

Tomáš Slanina
se narodil v roce 1988 v Lelekovicích. Magisterské studium organické chemie absolvoval na Masarykově univerzitě v Brně. Joint Ph.D. absolvoval kromě zmíněné brněnské univerzity ještě na německé univerzitě v Řezně. Poté díky grantu Nadace Experientia ve výši 870 tisíc korun vycestoval na postdoktorandskou stáž na německou Goetheho univerzitu ve Frankfurtu nad Mohanem k prof. Heckelovi. Projekt byl úspěšný, a tak mu prof. Heckel nabídl si pobyt v Německu ještě o půl roku prodloužit. Poté zamířil na druhou roční postdoktorandskou stáž do švédské Uppsaly. Od dubna 2019 působí jako vedoucí juniorské výzkumné skupiny na ÚOCHB AV ČR, která se věnuje redoxní fotochemii. Tomáš Slanina je také členem správní rady Nadace Experientia.